Sinh lý học loãng xương
25/06/2018
Đứng trên quan điểm sinh học cơ bản, loãng xương -- bất kì bệnh sinh nào -- đều xuất phát từ sự mất cân đối giữa hai qui trình tạo xương và hủy xương. Do đó, hiểu biết về cơ chế dẫn đến sự suy thoái của xương qua hai qui trình này sẽ giúp cho bác sĩ hiểu thêm về bệnh sinh loãng xương và những tiến bộ trong điều trị.
Hồ Phạm Thục Lan
Khoa khớp, Bệnh viện Nhân dân 115
Khoa nội, Đại học Y khoa Phạm Ngọc Thạch
Thành phố Hồ Chí Minh, Việt Nam
Nguyễn Văn Tuấn
Osteoporosis and Bone Biology Research Program
Garvan Institute of Medical Research
Faculty of Medicine, University of New South Wales
Sydney, Australia
Địa chỉ liên lạc
Bs Hồ Phạm Thục Lan
Khoa nội, Đại học Y khoa Phạm Ngọc Thạch
Đường Thành Thái
TP Hồ Chí Minh
Điện thoại:
Email: thuclanhopham@pnt.edu.vn
Tóm tắt
Đứng trên quan điểm sinh học cơ bản, loãng xương -- bất kì bệnh sinh nào -- đều xuất phát từ sự mất cân đối giữa hai qui trình tạo xương và hủy xương. Do đó, hiểu biết về cơ chế dẫn đến sự suy thoái của xương qua hai qui trình này sẽ giúp cho bác sĩ hiểu thêm về bệnh sinh loãng xương và những tiến bộ trong điều trị. Tuy nhiên, nhiều bài báo khoa học và sách giáo khoa mô tả sinh lí học loãng xương rất phức tạp và có khi lẫn lộn, làm cho bác sĩ chưa quen với sinh học phân tử cảm thấy khó hiểu. Trong bài này, chúng tôi sẽ trình bày một số cơ chế của qui trình tạo xương và loãng xương một cách đơn giản và hi vọng dễ hiểu hơn cho các bác sĩ lâm sàng.
Abstract
From a biologic viewpoint, osteoporosis – regardless of underlying pathophysiology – is resulted from the imbalance between two opposing processes known as bone formation and bone resorption. Therefore, understanding mechanisms leading to the deterioration of bone through the two processes can help doctors gain more insight into the pathogenesis of osteoporosis and recent developments in the treatment of osteoporosis. However, many papers and textbooks present the physiology of osteoporosis in a rather complicated description, which could lead to confusion and unnecessary complexity to those who are unfamiliar with molecular biology. In the review article, we will present some basic ideas and facts concerning the processes of bone modeling and remodeling, bone formation and resorption in a simple language, and we hope that the presentation will help clinicians better understand the underlying pathophysiology of osteoporosis.
1. Phân biệt loại xương
Loãng xương là hệ quả của sự rối loạn qui trình chuyển hóa xương dẫn đến mất chất khoáng trong xương, cấu trúc xương bị suy thoái, và gia tăng nguy cơ gãy xương (1). Gãy xương do đó là hệ quả của loãng xương.Loãng xương còn được xem là một căn bệnh âm thầm, hiểu theo nghĩa bệnh diễn tiến một cách âm thầm, không gây triệu chứng đặc hiệu, cho đến khi xương bị gãy. Do đó, cần phải học cách phát hiện bệnh kịp thời đề điều trị nhằm giảm nguy cơ gãy xương. Đối với bác sĩ lâm sàng, để phát hiện và điều trị căn bệnh âm thầm này đòi hỏi một vài hiểu biết về sinh lí bệnh loãng xương.
Khung xương con người có 206 xương. Những xương này có nhiều chức năng quan trọng như góp phần tạo nên dáng dấp cơ thể, hỗ trợ trọng lượng cơ thể, bảo vệ các bộ phận quan trọng trong cơ thể, và cùng với hệ thống cơ giúp cho chúng ta di chuyển dễ dàng. Xương còn là một “kho” lưu trữ chất khoáng như calcium và phosphorus. Một chức năng quan trọng khác là xương là nơi cung cấp tế bào gốc từ tủy xương phục vụ cho sự tăng trưởng của nhiều loại tế bào.
Dựa vào đặc điểm sinh lí, xương có thể chia làm hai loại: xương xốp (trabecular hay cancellous bones) và xương đặc (cortical bones). Tính chung, xương xốp chiếm khoảng 20% tổng khối lượng xương, và phần 80% còn lại là xương đặc. Xương xốp được cấu tạo bởi một mạng tế bào rất phức tạp và tinh vi. Do đó, xương xốp có độ chuyển hóa cao, có diện tích rộng hơn, và dễ bị gãy hơn xương đặc.
Xương xốp thường hay thấy ở hai phần đầu của những xương dài, như xương đùi và xương tay, những xương thường hay bị gãy. Xương xốp là loại xương chính, bao gồm xương phẳng như xương ức, xương chậu, và 33 đốt sống.
Xương đặc như tên gọi có mật độ chất khoáng dày đặc hơn xương xốp. Xương đặc thường bao quanh xương xốp, làm thành vòng đai bảo vệ xương xốp. Xương đặc thường hay thấy ở phần giữa các xương dài, kể cả xương chày, xương mác, xương đùi, xương quay (radius bone), xương trụ, và xương cánh tay. Ngoài việc cung cấp lực, xương đặc còn là nơi mà gân và cơ bám vào.
Xương chúng ta được cấu thành từ trong bụng mẹ. Xương dài của bào thai đã được “mô hình” để có hình dạng khi trưởng thành ngay từ tuần thứ 26 sau khi thụ thai. Sau khi sinh, xương được phát triển nhanh trong giai đoạn trước dậy thì. Khoảng 90% mật độ và khối xương đỉnh (peak bone mass) của một người được lưu trữ trong thời gian trước tuổi dậy thì. Tốc độ tăng trưởng mật độ xương (MĐX) trong thời kì trước tăng trưởng ở nữ nhanh hơn nam giới. Nhưng đến độ tuổi 20, mức độ khác biệt về MĐX giữa nam và nữ không còn khác nhau đáng kể. Sau thời kì tăng trưởng, MĐX trải qua một giai đoạn ổn định, và giai đoạn này kéo dài khoảng 5 đến 15 năm. Đây chính là giai đoạn MĐX đạt mức tối đa. Sau độ tuổi 35, MĐX bắt đầu suy giảm, nhất là sau mãn kinh. Mức độ suy giảm MĐX ở nữ thường cao hơn nam (Hình 1). Chính vì sự suy giảm MĐX, xương bị yếu, và dễ bị gãy.
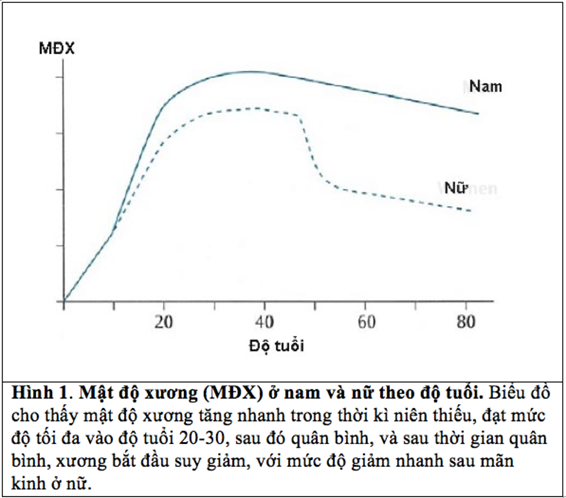
Hình 1. Mật độ xương (MĐX) ở nam và nữ theo độ tuổi. Biểu đồ cho thấy mật độ xương tăng nhanh trong thời kì niên thiếu, đạt mức độ tối đa vào độ tuổi 20-30, sau đó quân bình, và sau thời gian quân bình, xương bắt đầu suy giảm, với mức độ giảm nhanh sau mãn kinh ở nữ.
Do đó, trái lại với nhiều suy nghĩ, xương là một mô rất năng động. Có lẽ vì cấu trúc xương tương đối cứng, người ta thường nghĩ xương là một mô bất động. Nhưng trong thực tế, xương là một mô rất “bận rộn”, hiểu theo nghĩa có nhiều cơ chế chuyển hóa trong xương. Sự chuyển hóa của xương được kiểm soát bởi một hệ thống gồm các yếu tố hóa, cơ, điện, và từ. Trong hệ thống này, có nhiều tế bào tương tác với nhau, và tương tác với các tế bào tạo máu và tế bào mầm trong tủy xương. Những mối tương tác phức tạp này có vai trò đặc biệt quan trọng là duy trì khối lượng xương và nuôi dưỡng xương.
2. Mô hình và tái mô hình
Xương trải qua hai quá trình mô hình (modelling) và tái mô hình (remodelling). Hai quá trình này xảy ra với những cơ chế riêng biệt để biệt hoá các nhóm tế bào xương giúp đạt được sự tạo thành xương và / hoặc làm mới xương (2). Hai quá trình này, modeling và remodeling, phối hợp nhau trong quá trình phát triển xương để định dạng xương thích hợp, duy trì nồng độ huyết thanh của các ion, và sửa chữa các vùng cấu trúc xương bị tổn thương (3, 4).
Mô hình là qui trình chu chuyển xương lúc còn nhỏ (tuổi vị thành niên). Chức năng của qui trình mô hình là tạo dáng và chiều dài, hình dạng cho xương. Trong giai đoạn mô hình, MĐX gia tăng đến mức tối đa (4-6). Mô hình xương diễn ra trên bề mặt xương, và hai quá trình tạo và phân hủy xương xảy ra một cách độc lập. Một khi xương đạt tới mức trưởng thành, qui trình mô hình sẽ giảm rất nhiều, hoàn toàn không đáng kể so với trong giai đoạn phát triển (7-10). Tuy nhiên, qui trình mô hình có thể xảy ra sau giai đoạn trưởng thành, ở những bệnh lí có sự thay đổi của lực tác dụng lên xương (Bảng 1).
|
Bảng 1. Mô hình và tái mô hình xương
|
||
|
Đặc tính |
Mô hình (modelling) |
Tái mô hình (remodelling) |
|
Địa phương hóa |
Quá trình phân hủy bởi các tế bào hủy xương diễn ra một cách độc lập với quá trình tạo xương bởi các tế bào tạo xương |
Quá trình phân hủy và tạo xương xảy ra song song nhau |
|
Kết quả |
Ảnh hưởng đến kích thước và hình dạng của xương |
Ảnh hưởng đến mật độ, khoáng hóa, và vi cấu trúc của mô xương |
|
Thời gian |
Xảy ra rất dài (khoảng 18 năm), và hàn gắn xương (khoảng 1 năm) |
Xảy ra trong một thời gian ngắn: phân hủy xương cần khoảng 3 tuần, nhưng tạo xương cần đến 13 tuần |
|
Giai đoạn |
Quá trình mô hình dừng lại ở độ tuổi 18-20 (trước khi trưởng thành) |
Diễn ra một cách liên tục, suốt đời, nhưng tốc độ tái mô hình giảm dần với tuổi tác. |
Không giống như mô hình chỉ có hủy xương hoặc tạo xương tại một vị trí, qui trình tái mô hình luôn xảy ra theo trình tự kích hoạt, hủy xương, và tạo xương mà chúng tôi sẽ giải thích dưới đây (11). Tái mô hình có chức năng phân hủy những mảng xương cũ hay xương bị tổn hại, và thay thế bằng những mảng xương mới. Qui trình tái mô hình diễn ra liên tục (suốt đời), và 25% lượng xương xốp và 5% lượng xương đặc có thể được thay đổi trong vòng một năm (12, 13).
Tế bào
Ở bậc phân tử, xương được cấu thành từ 4 tế bào chính: tế bào tạo xương (osteoblast, OC), tế bào hủy xương (osteoclast), tế bào xương (osteocyte), và tế bào liên kết (lining cells). Những tế bào này tương tác với một số chất khoáng, protein, hormone, và các phân tử khác để nuôi dưỡng xương, và liên tục đục bỏ xương cũ và thay bằng xương mới qua một qui trình tái mô hình (13) (Bảng 2).
|
Bảng 2. Các tế bào tham gia trong qui trình tái mô hình xương
|
|
|
Tế bào trong xương |
Nguồn gốc và chức năng |
|
Tế bào hủy xương (osteoclast) |
Xuất phát từ tề bào tạo máu (hematopoietic cell). Tác động đến sự thay đổi cấu trúc xương. Di chuyển theo chiều dài của xương đặc khoảng 40 mm/ngày |
|
Tế bào tạo xương (osteoblast) |
Xuất phát từ trung bào mầm (mesenchymal stem cell, MSC). Tác động đến sự thay đổi cấu trúc xương. Tế bào tạo xương hình thành osteoid với tốc độ khoảng 1mm/ngày |
|
Tế bào xương (osteocyte) |
Xuất phát từ MSC. Đóng vai trò như là những tác nhân thụ cảm (sensor), cảm nhận stress trên xương và khởi động qui trình tái mô hình. |
|
Tế bào liên kết (bone lining cell) |
Là những tế bào tạo xương “nghỉ hưu”. Đóng vai trò như là những tác nhân thụ cảm (sensor), cảm nhận stress trên xương và khởi động qui trình tái mô hình. |
|
Đơn vị tái mô hình (basic multicellular unit – BMU) |
Là những “đội” tế bào, gồm có hàng chục tế bào hủy xương và hàng trăm tế bào tạo xương. |
Tế bào tạo xương (và cả tế bào xương) có nguồn gốc từ các tế bào gốc có tên là mesenchymal stem cell (MSC). Những tế bào MSC khi đặt trong điều kiện thích hợp có thể chuyển hóa thành tế bào xương, nhưng trong điều kiện khác chúng cũng có thể trở thành tế bào cơ, mỡ, hoặc sụn (14-18). MSC cần hai yếu tố để sản xuất tế bào tạo xương: đó là Runx2 và osterix (15, 19-21). Tế bào tạo xương chỉ “thọ” khoảng 3 tháng tuổi. Trong quá trình tái mô hình, tế bào tạo xương tạo ra những lớp xương và góp phần tạo lực của xương.
Tế bào xương: Một số tế bào tạo xương được “chôn” trong các lớp xương, và sau này sẽ trở thành tế bào xương (22). Tế bào xương rất phổ biến, chiếm đến 95% số tế bào có mặt trong xương. Tế bào xương có tuổi thọ trung bình là 25 năm.
Tế bào liên kết: Những tế bào tạo xương còn lại nằm trên bề mặt của xương, và chúng được gọi là tế bào liên kết (Hình 2). Các tế bào xương liên kết với nhau, và liên kết với các tế bào tạo xương, hình thành một mạng tế bào có chức năng chuyển giao tín hiệu và chuyển giao các chất dinh dưỡng trong xương (23).
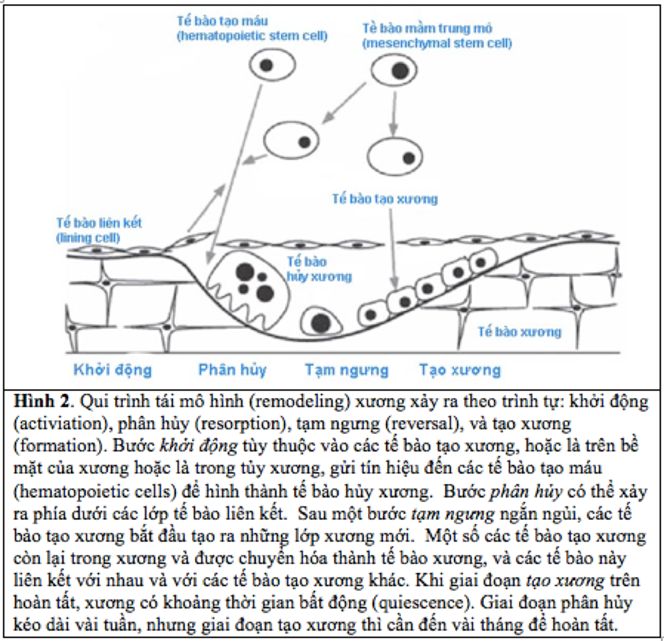
Hình 2. Qui trình tái mô hình (remodeling) xương xảy ra theo trình tự: khởi động (activiation), phân hủy (resorption), tạm ngưng (reversal), và tạo xương (formation). Bước khởi động tùy thuộc vào các tế bào tạo xương, hoặc là trên bề mặt của xương hoặc là trong tủy xương, gửi tín hiệu đến các tế bào tạo máu (hematopoietic cells) để hình thành tế bào hủy xương. Bước phân hủy có thể xảy ra phía dưới các lớp tế bào liên kết. Sau một bước tạm ngưng ngắn ngủi, các tế bào tạo xương bắt đầu tạo ra những lớp xương mới. Một số các tế bào tạo xương còn lại trong xương và được chuyển hóa thành tế bào xương, và các tế bào này liên kết với nhau và với các tế bào tạo xương khác. Khi giai đoạn tạo xương trên hoàn tất, xương có khoảng thời gian bất động (quiescence). Giai đoạn phân hủy kéo dài vài tuần, nhưng giai đoạn tạo xương thì cần đến vài tháng để hoàn tất.
Tế bào hủy xương là những tế bào xuất phát từ tế bào tạo máu (24). Tế bào hủy xương có chức năng đục bỏ xương cũ hay xương bị tổn hại qua một qui trình phân hủy chất khoáng có tên là resorption hay hủy xương (25, 26) . Trong điều kiện bình thường, chức năng của tế bào hủy xương và tế bào tạo xương hoạt động song song nhau và mức độ tương đương nhau, với tín hiệu của tế bào này ảnh hưởng đến tế bào kia. Trong điều kiện bình thường như thế, lượng xương bị đào thải bằng lượng xương mới thay vào (Hình 3).
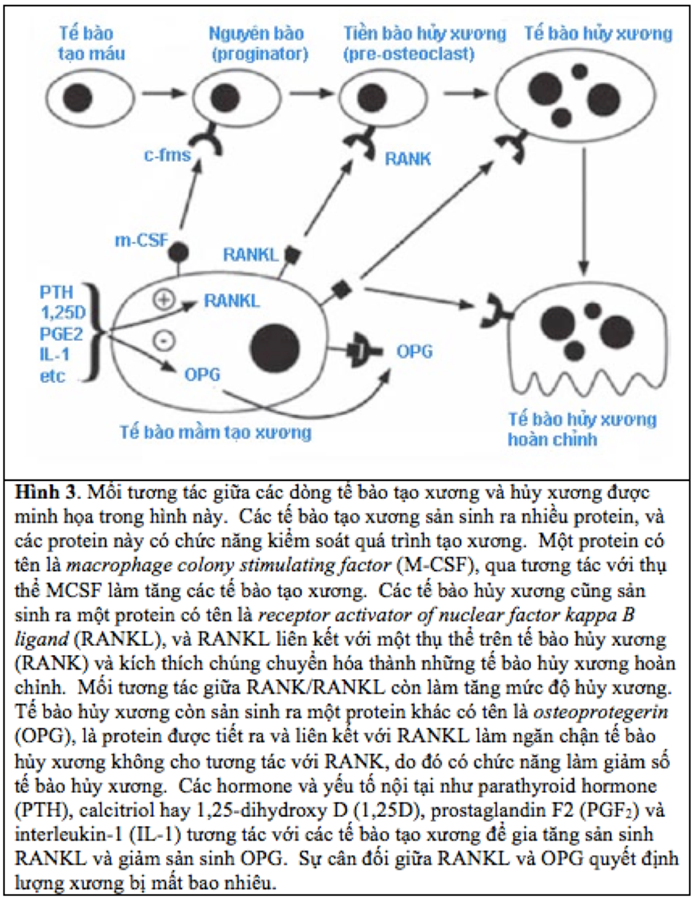
Hình 3. Mối tương tác giữa các dòng tế bào tạo xương và hủy xương được minh họa trong hình này. Các tế bào tạo xương sản sinh ra nhiều protein, và các proteinnày có chức năng kiểm soát quá trình tạo xương. Một protein có tên là macrophage colony stimulating factor (M-CSF), qua tương tác với thụ thể MCSF làm tăng các tế bào tạo xương. Các tế bào hủy xương cũng sản sinh ra một protein có tên là receptor activator of nuclear factor kappa B ligand (RANKL), và RANKL liên kết với một thụ thể trên tế bào hủy xương (RANK) và kích thích chúng chuyển hóa thành những tế bào hủy xương hoàn chỉnh. Mối tương tác giữa RANK/RANKL còn làm tăng mức độ hủy xương. Tế bào hủy xương còn sản sinh ra một protein khác có tên là osteoprotegerin (OPG), là protein được tiết ra và liên kết với RANKL làm ngăn chận tế bào hủy xương không cho tương tác với RANK, do đó có chức năng làm giảm số tế bào hủy xương. Các hormone và yếu tố nội tại như parathyroid hormone (PTH), calcitriol hay 1,25-dihydroxy D (1,25D), prostaglandin F2 (PGF2) và interleukin-1 (IL-1) tương tác với các tế bào tạo xương để gia tăng sản sinh RANKL và giảm sản sinh OPG. Sự cân đối giữa RANKL và OPG quyết định lượng xương bị mất bao nhiêu.
Loãng xương là hệ quả của sự mất cân đối giữa qui trình tạo xương và hủy xương; trong đó mức độ hủy xương cao hơn mức độ tạo xương. Sự mất cân đối dẫn đến tình trạng cơ thể bắt đầu mất xương. Mất xương dẫn đến tình trạng lực của xương suy giảm, và làm tăng nguy cơ gãy xương (Hình 4). Bởi vì tế bào hủy xương là những tế bào chính trong qui trình phân hủy xương, hầu hết các thuốc được phát triển để điều trị loãng xương đặt mục tiêu ức chế các tế bào hủy xương.
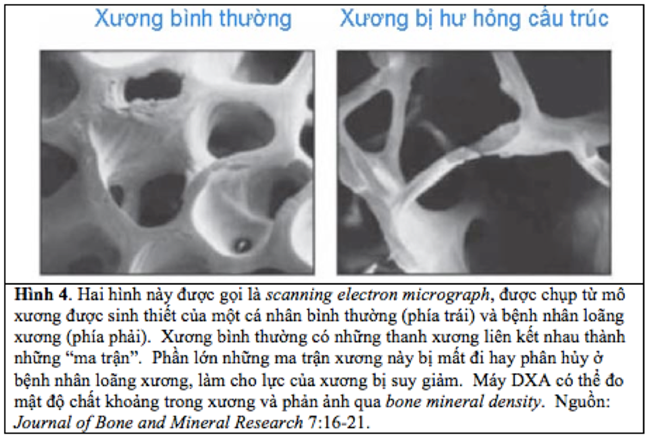
Hình 4. Hai hình này được gọi là scanning electron micrograph, được chụp từ mô xương được sinh thiết của một cá nhân bình thường (phía trái) và bệnh nhân loãng xương (phía phải). Xương bình thường có những thanh xương liên kết nhau thành những “ma trận”. Phần lớn những ma trận xương này bị mất đi hay phân hủy ở bệnh nhân loãng xương, làm cho lực của xương bị suy giảm. Máy DXA có thể đo mật độ chất khoảng trong xương và phản ảnh qua bone mineral density. Nguồn: Journal of Bone and Mineral Research 7:16-21.
Qui trình tái mô hình
Bộ xương liên tục sửa chữa và tự làm mới trong một quá trình có tên là tái mô hình (Hình 2) (4, 5). Qui trình này có chức năng duy trì mật độ xương (bone mineral density) ở mức tối ưu. Ngoài ra, qui trình tái mô hình còn có chức năng sửa chữa những xương bị tổn hại, kể cả những xương bị “vi nức” (microcrack) hay gãy xương. Tại sao xương bị suy giảm và mật độ xương bị mất? Xương bị suy giảm khi các tế bào hủy xương tạo ra những lỗ phân hủy sâu, hoặc khi các tế bào tạo xương không có khả năng lắp vào những lỗ hổng do các tế bào hủy xương bỏ lại. Qui trình tái mô hình xảy ra tại những địa điểm gần trên bề mặt của xương, và ngay phía dưới các tế bào liên kết (Hình 2).
Việc phân hủy xương cũ và thay thế xương mới trong qui trình tái mô hình xảy ra theo trình tự 4 bước: khởi động, phân hủy, tạm ngừng, và tạo xương (12) (Hình 2). Trong giai đoạn khởi động, các dòng tế bào tạo xương tương tác với các tế bào tạo máu để sản sinh ra các tế bào hủy xương, bắt đầu bằng sự kích thích tế bào xương từ những vi tổn thương của mô xương, làm tế bào này tiết ra các chất hóa học đựoc dẫn truyền tới tế bào liên kết (22), và tế bào liên kết phô diễn (expression) yếu tố RANKL trên bề mặt kích họat sự tạo thành tế bào hủy xương từ tế bào tạo máu (12). Đến giai đoạn phân hủy, một “đội quân” tế bào hủy xương đục bỏ những xương bị tổn hại hay xương cũ bằng cách phân hủy các chất khoáng và để lại những lỗ hổng trên bề mặt xương. Sau đó là một giai đoạn trung gian ngắn được gọi là giai đọan “tạm ngưng” (reversal phase) để các tế bào đơn nhân giống đại thực bào thu dọn các mảnh vụn (debris) được thải ra trong quá trình phân hủy xương, các tế bào tạo xương xuất hiện và bắt đầu sửa chữa những xương bị tổn hại bằng xương mới. Trong quá trình này, một số tế bào tạo xương còn lưu lại trong mô xương và được chuyển hóa thành các tế bào xương thật sự (osteocyte). Một khi xương mới được khoáng hóa, qui trình tái mô hình coi như hoàn tất trong một vùng xương nào đó, quá trình tạo xương chấm dứt, tiếp theo đó là khoảng bất động (quiescence) cho tới khi bắt đầu một qui trình tái mô hình mới.
Thời gian phân hủy xương ngắn hơn thời gian tạo xương. Giai đoạn phân hủy chỉ kéo dài vài tuần. Nhưng giai đoạn tạo xương có thề kéo dài đến vài tháng để hoàn tất. Qui trình tái mô hình xảy ra suốt đời, và theo chu kì. Một chu kì tái mô hình kéo dài từ 6 đến 9 tháng. Trong thời kì trưởng thành (trên 30 tuổi) xương được thay thế theo chu kì khoảng 10 năm.
Tái mô hình là qui trình cần thiết để duy trì lực của xương. Qui trình này có thể diễn ra trên bề mặt của xương. Trước khi bước vào giai đoạn trưởng thành, quá trình tạo xương diễn ra với mức độ cao hơn quá trình hủy xương, và do đó, mật độ xương tăng nhanh trong thời kì này. Mật độ xương đạt mức độ cao nhất trong độ tuổi 20 – 30, và các yếu tố di truyền đóng vai trò quan trọng trong giai đoạn này. Sau khi xương đạt mức độ tối đa, xương bắt đầu suy giảm với tốc độ khác nhau theo độ tuổi. Sau thời kì mãn kinh vài năm (ở nữ) và sau độ tuổi 50 (ở nam), các tế bào hủy xương năng động hơn tế bào tạo xương, và dẫn đến tình trạng suy giảm mật độ xương và gia tăng nguy cơ gãy xương. Do đó, hiểu cơ chế phân hủy xương là một bước quan trọng đầu tiên để hiểu bệnh lí loãng xương.
Xương cần những chất dinh dưỡng như calcium, vitamin D, và phosphorus để xây dựng mô xương (27). Những khoáng chất này thường hấp thu qua nguồn thực phẩm. Dưới điều kiện bình thường, một phần calcium trong thực phẩm có thể hấp thu vào máu, và phần còn lại sẽ bài tiết qua đường ruột. Khi một người không ăn đầy đủ calcium và phosphorus, các hormone điều tiết cơ thể phản ứng bằng cách di chuyển các chất khoáng này khỏi xương để dùng cho các chức năng khác trong cơ thể. Nhưng khi qui trình này tiếp tục xảy ra nhiều lần thì xương trở nên yếu hơn và dễ dẫn đến gãy xương (28).
Một hệ thống phức tạp gồm các hormone có thể giúp duy trì cung ứng các chất khoáng cần thiết cho nhiều tình huống khác nhau (29). Những hormone này hoạt động không chỉ trên xương mà còn trên các mô khác (như ruột, thận) để cung cấp các nguyên tố cần thiết cho cơ thể. Những cơ chế này tùy thuộc vào một mạng tinh vi bao gồm các phân tử phát tín hiệu (messenger molecules) và sẽ được bàn đến trong phần kế tiếp.
3. Các yếu tố ảnh hưởng đến chuyển hóa của xương
Estrogen và testosterone là hai hormone đóng vai trò quan trọng trong giai đoạn tạo xương (30). Tác động của estrogen đến xương là qua thụ thể estrogen (estrogen receptor, ER)(31, 32). Ảnh hưởng của estrogen đến qui trình tái mô hình là làm giảm lượng tế bào và hoạt động của tế bào hủy xương (33). Estrogen còn tác động đến sự phát sinh và hình thành các enzyme và protein qua những cơ chế phức tạp liên quan đến các hormone khác. Tính trung bình, phụ nữ mất khoảng 50% xương xốp và 35% xương đặc trong quãng đời. Nhưng chưa ai biết bao nhiêu phần trăm của sự mất xương này là do thiếu (hay suy giảm) estrogen, và bao nhiêu là do các yếu tố liên quan đến sự lão hóa hay các yếu tố môi trường. Tuy nhiên có ước tính cho rằng khoảng 25% xương xốp và 15% xương đặc bị mất là do suy giảm / thiếu estrogen. Estrogen tác động đến các tế bào tạo xương và tế bào hủy xương để ức chế sự phân hủy xương trong mọi giai đoạn trong qui trình tái mô hình xương. Ngay thời điểm hay sau thời kì mãn kinh, estrogen bị suy giảm, và hệ quả là mật độ xương cũng suy giảm nhanh chóng, nhất là trong 5 năm đầu sau mãn kinh (34).
Testosterone kích thích sự tăng trưởng của cơ, và tác động tích cực đến quá trình tạo xương. Testosterone còn sản sinh ra estrogen trong quá trình tác động đến cơ và xương. Hiện nay, các chuyên gia đều đồng ý rằng testosterone chẳng những đóng vai trò quan trọng trong sức khỏe xương ở nam giới mà còn ở nữ giới. Ngược lại, estrogen cũng có vai trò tăng trưởng mật độ xương ở nam giới (35).
Các phân tử tín hiệu
Chức năng tạo xương và hủy xương và chuyển hóa xương nói chung được điều phối bởi một số yếu tố toàn thân và yếu tố nội tại. Những yếu tố này bao gồm (xem Bảng 3):
- Các yếu tố toàn thân (systemic factors) có vai trò trong việc duy trì quân bình calcium
- Các yếu tố nội tại (local factors) ảnh hưởng đến sự vận hành của tế bào
- Cytokines và CSF (colony stimulating factors) ảnh hưởng đến sự phát triển của tế bào hủy xương
- Các yếu tố tăng trưởng (growth factors) kích thích sản sinh các tế bào tạo xương và biệt hóa tế bào
|
Bảng 3. Các yếu tố ảnh hưởng đến chu chuyển xương
|
||
|
Yếu tố |
Tế bào và mô chịu tác động |
Tác động |
|
PTH |
Thận và xương |
Kích thích sự sản sinh vitamin D (1,25D) và giúp chuyển calcium từ xương đến máu. |
|
Calcitonin (từ tuyến giáp) |
Tế bào hủy xương |
Ức chế các tế bào hủy xương; giảm nồng độ calcium trong máu. |
|
Calcitriol (1,25D) |
Tế bào tạo xương |
Kích thích sản sinh chất keo (collagen), osteopontin, osteocalcin; tăng nồng độ calcium trong máu; kích thích các tế bào hủy xương; kích thích lưu giữ calcium |
|
|
Tế bào hủy xương, thận ruột |
Kích thích hấp thu calcium |
|
Estrogen |
Xương |
Kích thích thụ thể calcitonin, ức chế quá trình hủy xương, cũng có thể kích thích quá trình tạo xương |
|
Testosterone |
Cơ, xương |
Kích thích tăng trưởng của cơ, tăng stress trên xương, tăng quá trình tạo xương |
|
Prostaglandins |
Tế bào hủy xương |
Kích thích quá trình hủy xương và tạo xương |
|
Bone morphogenic protein (BMP) |
Mesenchyme |
Kích thích sản sinh sụn, và “ma trận” xương |
|
Transforming growth factor (TGF-b) |
Tế bào hủy xương, chondrocytes |
Kích thích biệt hóa |
|
Interleukins IL-1, IL-3, IL-6, IL-11 |
Tủy, tế bào hủy xương |
Kích thích tế bào tạo xương |
|
Tumor necrosis factor (TNF-a), granulocyte-macrophage stimulating factor (GMCSF) |
Tế bào hủy xương |
Kích thích quá trình hủy xương |
|
Leukemic inhibitory factor |
Tế bào tạo xương, tế bào hủy xương |
Kích thích tế bào tạo xương và tế bào hủy xương trong tủy |
Các hormone điều tiết calcium
Hormone tuyến cận giáp (PTH), calcitriol, và calcitonin là những hormone kiểm soát calcium. Các hormone này đóng vai trò duy trì sức khỏe của xương. PTH giúp duy trì nồng độ calcium trong máu, tăng trưởng cả hai qui trình tạo xương và hủy xương (36). PTH giúp di chuyển calcium khỏi xương vào máu, nhưng khi PTH gia tăng sẽ dẫn đến chứng cường phó giáp (hyperparathyroidism) và dẫn đến mất xương. Calcitriol hay 1,25D được sản sinh từ cholecalciferol. Chức năng của 1,25D là kích thích ruột hấp thu calcium và phosphorus (37). Calcitonin được sản sinh từ tuyến giáp và ức chế các tế bào hủy xương . Calcitonin còn đóng vai trò quan trọng trong việc duy trì sự phát triển của xương và kiểm soát nồng độ calcium .
Các yếu tố tăng trưởng và cytokines là những yếu tố trung gian có chức năng kiểm soát “mối liên lạc” giữa các tế bào hủy xương và tế bào tạo xương, và qua đó kiểm soát sự phân hủy xương (38). Tương tự, làm gia tăng các yếu tố tăng trưởng và gia tăng các tế bào tạo xương trong giai đoạn phân hủy xương (trong qui trình tái mô hình). Bằng chứng từ nghiên cứu cơ bản cho thấy trong các yếu tố tăng trưởng có tác động đến qui trình tăng trưởng của xương, IL-6 được xem là quan trọng nhất.
Cytokine
“Dấu ấn” của loãng xương do thiếu estrogen là sự mất xương. Mất xương trong qui trình tái mô hình là do tăng các tế bào hủy xương so với các tế bào tạo xương. Những cytokines sau đây được xem là đóng vai trò quan trọng trong cơ chế estrogen – xương:
TRANCE/RANKL/OPGL: Thuật ngữ này đề cập đến một cytoline có tên là TRANCE (tumor necrosis factor-related activation-induced cytokine), receptor activator of NFkB ligand (RANKL), hoặc osteoprotegerin ligand (OPGL).
Macrophase colony stimuating factor (M-CSF)
Granulocyte/monocyte-colony stimulating factor (GM-CSF)
Interleukin 1 (IL-1)
Interleukin 6 (IL-6)
Các yếu tố tăng trưởng IL-1, IL6 và TNF được sản sinh bởi các đơn bào (monocyte) và đại bào (macrophage) cũng như các hormone toàn thân như PTH và 1,25D. Các yếu tố tăng trưởng điều phối tác động của estrogen đến các tế bào tạo xương và hủy xương. Ngoài ra, các yếu tố này còn kích thích sự biệt hóa các tế bào hủy xương bằng cách gia tăng cytokines.
4. Kết luận
Xương là một mô rất năng động bao gồm hai chất hữu cơ và vô cơ được sản xuất bởi các tế bào chuyên biệt, trong đó quan trọng nhất là tế bào tạo xương và tế bào hủy xương. Các tế bào này vận hành theo từng nhóm (gọi là BMU – basic multicellular unit) để phân hủy xương cũ và thay thế vào đó xương mới. Những thay đổi về mật độ xương phụ thuộc vào sự cân đối giữa hai qui trình tạo xương và phân hủy xương. Lực của xương phụ thuộc vào cơ cấu và mật độ xương. Sự vận hành của các tế bào tạo xương và phân hủy xương chịu sự chi phối của nhiều hormone, kể cả estrogen và testosterone, 1,25D, và PTH. Mức độ chu chuyển xương và hoạt động của các tế bào tạo và hủy xương có thể đánh giá qua các marker chu chuyển xương.
Tóm lại, sinh lí loãng xương rất phức tạp và còn rất nhiều vấn đề vẫn chưa hiểu hết được. Những hiểu biết về sự “ra đời” và cơ chế vận hành của tế bào tạo xương và tế bào hủy xương đã được nghiên cứu nhiều, nhưng tế bào xương vẫn chưa ai hiểu biết hết. Tuy nhiên, những kiến thức về cơ chết tạo và phân hủy xương đã giúp chúng ta có được một số liệu pháp hữu hiệu để phát hiện và điều trị loãng xương nhằm giảm nguy cơ gãy xương ở qui mô cộng đồng.
Thuật ngữ Anh – Việt
|
Anh |
Việt |
|
Bone mineral density |
Mật độ xương |
|
Peak bone mineral density |
Mật độ xương đỉnh |
|
Modeling |
Mô hình |
|
Remodeling |
Tái mô hình |
|
Osteoblast |
Tế bào tạo xương |
|
Osteoclast |
Tế bào phân hủy xương |
|
Bone formation |
Tạo xương |
|
Bone resorption |
Phân hủy xương |
|
Osteocyte |
Tế bào xương |
|
Lining cells |
Tế bào liên kết |
|
Hematopoietic cell |
Tế bào tạo máu |
|
Mesenchymal stem cell |
Trung bào mầm |
|
Dual X-ray absorptiometry (DXA) |
Hấp thu năng lượng kép |
Tài liệu tham khảo
- National Institute of Health (NIH): Osteoporosis prevention, diagnosis, and therapy. Jama 2001;285(6):785-95.
- Frost HM. 1963. Bone Remodelling Dynamics. Springfield, IL: Charles C.Thomas. In.
- Frost,HM.1986. Intermediary Organization of the Skeleton. Boca Raton, FL:CRC. Press. In.
- Jee WS, Frost HM. Skeletal adaptations during growth. Triangle 1992;31(2/3):77-88.
- Frost HM. Obesity, and bone strength and "mass": a tutorial based on insights from a new paradigm. Bone 1997;21(3):211-4.
- Hillam RA, Skerry TM. Inhibition of bone resorption and stimulation of formation by mechanical loading of the modeling rat ulna in vivo. J Bone Miner Res 1995;10(5):683-9.
- Frost HM. 1973. Bone Modeling and Skeletal Modeling Errors. Springfield, IL:Charles C. Thomas. In.
- Garn SM. 1970. The Earlier Gain and the Later Loss of Cortical Bone. Springfield, IL: Charles C. Thomas. In.
- Lazenby RA. Continuing periosteal apposition. II: The significance of peak bone mass, strain equilibrium, and age-related activity differentials for mechanical compensation in human tubular bones. Am J Phys Anthropol 1990;82(4):473-84.
- Lazenby RA. Continuing periosteal apposition. I: Documentation, hypotheses, and interpretation. Am J Phys Anthropol 1990;82(4):451-72.
- Parfitt AM. Quantum concept of bone remodeling and turnover: implications for the pathogenesis of osteoporosis. Calcif Tissue Int 1979;28(1):1-5.
- Zaidi M. Skeletal remodeling in health and disease. Nat Med 2007;13(7):791-801.
- Datta HK, Ng WF, Walker JA, Tuck SP, Varanasi SS. The cell biology of bone metabolism. J Clin Pathol 2008;61(5):577-87.
- Bendall AJ, Abate-Shen C. Roles for Msx and Dlx homeoproteins in vertebrate development. Gene 2000;247(1-2):17-31.
- Ducy P, Zhang R, Geoffroy V, Ridall AL, Karsenty G. Osf2/Cbfa1: a transcriptional activator of osteoblast differentiation. Cell 1997;89(5):747-54.
- Komori T, Yagi H, Nomura S, Yamaguchi A, Sasaki K, Deguchi K, et al. Targeted disruption of Cbfa1 results in a complete lack of bone formation owing to maturational arrest of osteoblasts. Cell 1997;89(5):755-64.
- Otto F, Thornell AP, Crompton T, Denzel A, Gilmour KC, Rosewell IR, et al. Cbfa1, a candidate gene for cleidocranial dysplasia syndrome, is essential for osteoblast differentiation and bone development. Cell 1997;89(5):765-71.
- Robledo RF, Rajan L, Li X, Lufkin T. The Dlx5 and Dlx6 homeobox genes are essential for craniofacial, axial, and appendicular skeletal development. Genes Dev 2002;16(9):1089-101.
- Glass DA, 2nd, Bialek P, Ahn JD, Starbuck M, Patel MS, Clevers H, et al. Canonical Wnt signaling in differentiated osteoblasts controls osteoclast differentiation. Dev Cell 2005;8(5):751-64.
- Hu H, Hilton MJ, Tu X, Yu K, Ornitz DM, Long F. Sequential roles of Hedgehog and Wnt signaling in osteoblast development. Development 2005;132(1):49-60.
- Nakashima K, Zhou X, Kunkel G, Zhang Z, Deng JM, Behringer RR, et al. The novel zinc finger-containing transcription factor osterix is required for osteoblast differentiation and bone formation. Cell 2002;108(1):17-29.
- Aarden EM, Burger EH, Nijweide PJ. Function of osteocytes in bone. J Cell Biochem 1994;55(3):287-99.
- Baud CA. Submicroscopic structure and functional aspects of the osteocyte. Clin Orthop Relat Res 1968;56:227-36.
- Udagawa N, Takahashi N, Akatsu T, Tanaka H, Sasaki T, Nishihara T, et al. Origin of osteoclasts: mature monocytes and macrophages are capable of differentiating into osteoclasts under a suitable microenvironment prepared by bone marrow-derived stromal cells. Proc Natl Acad Sci U S A 1990;87(18):7260-4.
- McHugh KP, Hodivala-Dilke K, Zheng MH, Namba N, Lam J, Novack D, et al. Mice lacking beta3 integrins are osteosclerotic because of dysfunctional osteoclasts. J Clin Invest 2000;105(4):433-40.
- Vaananen K. 1996. Osteoclast function: biology and mechanisms. In Principles of Bone Biology, ed. JP Bilezikian, LG Raisz, GA Rodan, pp. 103–13. New York: Academic. In.
- Cumming RG. Calcium intake and bone mass: a quantitative review of the evidence. Calcif Tissue Int 1990;47(4):194-201.
- Holbrook TL, Barrett-Connor E, Wingard DL. Dietary calcium and risk of hip fracture: 14-year prospective population study. Lancet 1988;2(8619):1046-9.
- Manolagas SC, Jilka RL. Bone marrow, cytokines, and bone remodeling. Emerging insights into the pathophysiology of osteoporosis. N Engl J Med 1995;332(5):305-11.
- Edwards MW, Bain SD, Bailey MC, Lantry MM, Howard GA. 17 beta estradiol stimulation of endosteal bone formation in the ovariectomized mouse: an animal model for the evaluation of bone-targeted estrogens. Bone 1992;13(1):29-34.
- Kuiper GG, van den Bemd GJ, van Leeuwen JP. Estrogen receptor and the SERM concept. J Endocrinol Invest 1999;22(8):594-603.
- Bord S, Horner A, Beavan S, Compston J. Estrogen receptors alpha and beta are differentially expressed in developing human bone. J Clin Endocrinol Metab 2001;86(5):2309-14.
- Pacifici R, Brown C, Puscheck E, Friedrich E, Slatopolsky E, Maggio D, et al. Effect of surgical menopause and estrogen replacement on cytokine release from human blood mononuclear cells. Proc Natl Acad Sci U S A 1991;88(12):5134-8.
- Vedi S, Purdie DW, Ballard P, Bord S, Cooper AC, Compston JE. Bone remodeling and structure in postmenopausal women treated with long-term, high-dose estrogen therapy. Osteoporos Int 1999;10(1):52-8.
- Khosla S, Melton LJ, 3rd, Atkinson EJ, O'Fallon WM. Relationship of serum sex steroid levels to longitudinal changes in bone density in young versus elderly men. J Clin Endocrinol Metab 2001;86(8):3555-61.
- Goltzman D. Studies on the mechanisms of the skeletal anabolic action of endogenous and exogenous parathyroid hormone. Arch Biochem Biophys 2008;473(2):218-24.
- Holick MF, Chen TC. Vitamin D deficiency: a worldwide problem with health consequences. Am J Clin Nutr 2008;87(4):1080S-6S.
- Kratchmarova I, Blagoev B, Haack-Sorensen M, Kassem M, Mann M. Mechanism of divergent growth factor effects in mesenchymal stem cell differentiation. Science 2005;308(5727):1472-7.